
药物的质量和有效性在很大程度上取决于其正确的包装:无菌产品和对水分/氧气敏感的药物在产品的保质期内(长达数年)需要出色的阻隔性,以保护其免受生物污染,水和氧气的侵入。否则,可能会导致严重的后果。1970年代的发生的一次严重事件证明了这一点:在此期间,装在玻璃瓶中的受污染静脉注射液(当时是包装这种剂型的典型现象)引起了大约2,000至8,000次血液感染,导致约有10%的患者死亡。这次严重的包装完整性故障事件引发了人们对生命科学行业中包装完整性的意识的增强。
污染的主要风险是湿度,氧气或微生物的入侵,这可能会影响整个产品生命周期中的药物稳定性。为防止高度水分敏感性药物(例如吸入干燥粉末)的稳定性失败或无菌肠胃外药物生物入侵的风险,需要进行高灵敏度的完整性测试。
由于没有一种解决方案能够满足特定产品的所有不同挑战,因此上海奇宜提供了多种不同的泄漏测试方法来应对制药行业的众多挑战。
制药行业的包装密封性测试–挑战和解决方案药物的质量,安全性和有效性在很大程度上取决于其正确的包装:无菌产品和对水分/氧气敏感的药物在产品的保质期内需要出色的阻隔性(最多两次/年)。污染的主要风险是湿度,氧气或微生物的入侵,这可能会影响整个产品生命周期中的药物稳定性。为了防止出现稳定性故障的风险,需要进行高灵敏度的完整性测试。

在2000年发表的一项研究中,评估了与不同口径相关的微生物入侵风险。如图1所示,临界泄漏尺寸为0.2 µm,分别为6·10-6 mbar l / s。该值被广泛用作所谓的MALL(最大允许泄漏水平)。
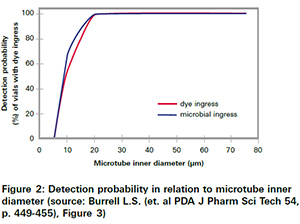
在查看其他研究时必须牢记这一点,这些研究已证明经典的概率测试方法可能会漏漏,导致产品无菌性受损。具体示例是微生物入侵测试以及蓝染料测试方法。如图2所示,这些方法检测到10 µm泄漏的机会只有大约70%。低于5 µm的任何泄漏或多或少都无法检测到。
2008年,美国FDA发布了针对整个生命科学行业的新指南(制药公司,兽医药品和生产无菌医疗产品的公司),该部门必须对该行业进行可靠的物理测量,以确保适当的
CCI。本指南主要针对无菌和关键药品(例如小瓶和注射器),分为3章:
-
1207.1:包装完整性和测试方法选择
-
1207.2:包装完整性泄漏测试方法
-
1207.3:包装密封质量测试方法
因此,USP并没有要求描述所有可能的方法,但是为评估各种流行的潜在方法提供了很好的概述和一般指导。
因此,多种不同测试方法的主要原因是,没有一种测试方法能够涵盖在药物包装的开发和生产过程中需要进行的所有所需质量检查。在包装的早期开发阶段(“包装设计阶段”),需要在MALL(最大允许泄漏极限)处测试包装的缺陷,通常在0.2 µm的范围内,分别为6·10-6 mbar l /秒。相比之下,对以120至600零件/分钟的速度运行的生产线进行100%的检查通常会以更高的检测极限进行测试。因此,基于成本,技术和产品之间基于风险的决策来定义生产单元的检测极限(LOD)。为了弥补这种基于风险的方法,附加的离线样品测试在1到10 µm的范围内进行了更严格的规范。这也适用于在实验室测试中执行的稳定性测试。
作为选择正确的测试方法的附加因素,还需要考虑包装和产品类型。这些大致分为刚性和柔性包装以及液体和固体药物。在选择正确的完整性测试方法方面,包装的透明性及其导电性等特性也起着重要的作用。





